

Document Type : Research Paper
Authors
1 Department of Agronomy and Plant Breeding, Faculty of Agricultural Science, University of Guilan, Rasht, Iran.
2 Department of Agronomy and Plant Breeding, Faculty of Agricultural Science, University of Guilan, Rasht, Iran
3 Department of Agronomy, Tarbiat Modares University, Tehran, Iran
Abstract
Keywords
Main Subjects
مقدمه
گیاه نعناع فلفلی (Mentha piperita L.) بومی مناطق مدیترانه ای است و در تمام نقاط دنیا برای مصارف غذایی، دارویی، عطرسازی و درمانی کشت می شود (McKay & Blumberg, 2006). اسانس نعناع فلفلی به دلیل بهبود ناراحتی های دستگاه گوارشی، سندروم روده تحریک پذیر، کولیک کودکان و قابلیت تسکین دردهای آرتریتی، روماتیسمی و دردهای مزمن در صنایع داروسازی کاربرد فراوانی دارد (Adel et al., 2015). منتول، مهمترین جزء اسانس نعناع فلفلی است که همران با منتون و سایر ترکیبات اسانس، مسئول ایجاد طعم و عطر خنک نعناع می باشند (Kamatou et al., 2013). در پروفایل اسانس نعناع فلفلی، هر چه مقدار منتول و منتون بالاتر باشد، اسانس دارای کیفیت بالاتری خواهد بود (Rios-Estepa et al., 2008). اسانس این گیاه یکی از معروفترین و رایجترین روغنهای اسانس مورد استفاده است و این بهدلیل ترکیبهای اصلی آن یعنی منتول و منتون میباشد که خاصیت ضد میکروبی دارند (SeifSahandi et al., 2019)، لذا توسعه کشت نعناع فلفلی و بکارگیری روش های صحیح مدیریتی برای بهبود کیفیت اسانس آن اهمیت فراوانی دارد (Mucciarelli et al., 2001).
کیفیت ماده مؤثره در زراعت گیاهان دارویی اهمیت بیشتری نسبت به کمیت محصول دارد، اما با توجه به اهمیت و نقش گیاهان دارویی در صنایع مختلف، امروزه رویکرد جهانی در تولید این گیاهان، بهبود کمیت و کیفیت ماده مؤثره می باشد. نتایج تحقیقات نشان داده است که یکی از عوامل زراعی مؤثر در رشد و عملکرد کمی و کیفی گیاهان دارویی، تغذیه گیاهان می باشد (Heidarzadehet al., 2020). اسیدهیومیک (C187H186O89N9S) یک ترکیب آلی است که اثرات آن بر رشد گیاهان مورد توجه قرار گرفته است. نتایج بررسیهای محققان نشان دادهاند که استفاده از اسیدهیومیک میتواند به عنوان یک روش مؤثر در کاهش تنش خشکی در گیاهان عمل کند (Ahmad et al., 2020). اسیدهیومیک میتواند با افزایش قابلیت نفوذپذیری خاک، بهبود جذب آب و عناصر غذایی و افزایش پایداری خاک در برابر تنش خشکی کمک کند. همچنین، اسیدهیومیک میتواند با افزایش فعالیت آنزیمهای دفاعی گیاه، بهبود مقاومت گیاهان در برابر تنش خشکی را فراهم کند. در مجموع، به نظر میرسد که استفاده از اسیدهیومیک، بهعنوان یک روش پایدار و موثر در کاهش تنش خشکی در گیاهان، میتواند مورد استفاده قرار گیرد
(Ahmad et al., 2020). نتایج مطالعات اخیر نشان دادهاند که استفاده از اسیدهیومیک میتواند بهبود عملکرد گیاهان در شرایط خشکی را تسریع کرده و تأثیرات مثبتی روی رشد و عملکرد گیاهان داشته باشد. به علاوه، اسیدهیومیک میتواند بهبود خصوصیات فیزیولوژیکی گیاهان مانند فعالیت آنزیمهای دفاعی و جذب آب و عناصر غذایی را افزایش دهد (Canellas et al., 2015). مطالعات دیگری نیز نشان دادهاند که اسیدهیومیک میتواند با بهبود خصوصیات خاک و افزایش توانایی خاک در نگهداری آب، تأثیرات مثبتی روی کاهش تنش خشکی در گیاهان داشته باشد (Chen et al., 2019).
سرکه چوب یک ماده آلی است که به دلیل داشتن ترکیبات مفیدی مانند اسیداستیک، فنولها، کربوکسیلات و آلدهیدها، به عنوان یک عامل مؤثر در بهبود رشد و عملکرد گیاهان در شرایط تنش کم آبی شناخته شده است. نتایج برخی از تحقیقات نشان دادهاند که استفاده از سرکه چوب میتواند باعث افزایش تعداد ریشههای فرعی در گیاهان شود که بهبود جذب آب و عناصر غذایی را به دنبال داشته و در نتیجه باعث بهبود رشد و عملکرد گیاه میشود (Khan et al., 2019). علاوه بر این، شیوع بیماریها و آفتهای گیاهی در شرایط تنش خشکی به دلیل ضعف گیاه، افزایش مییابد، اما استفاده از سرکه چوب میتواند به عنوان یک ماده ضد قارچ و ضد آفت برای گیاهان عمل کند. به طور کلی، به دلیل داشتن ترکیبات مفید، سرکه چوب میتواند به عنوان یک راه حل طبیعی و مؤثر در بهبود رشد و عملکرد گیاهان در شرایط تنش خشکی مورد استفاده قرار گیرد (Khan et al., 2019). تحقیقات نشان دادهاند که استفاده از سرکه چوب به عنوان یک محرک رشد گیاه در شرایط تنش خشکی میتواند باعث افزایش رشد گیاه و افزایش مقاومت آن در برابر تنش خشکی شود (Khan et al., 2019). سرکه چوب به دلیل داشتن ترکیبات آلی مفید، میتواند به عنوان یک راه حل طبیعی، عامل محرک و مؤثر در بهبود عملکرد گیاهان در شرایط تنش کم آبی استفاده شود (Uddin et al., 2014; Ahmed et al., 2019).
با توجه به موارد بالا، این پژوهش به منظور بررسی محلولپاشی اسیدهیومیک و سرکه چوب در شرایط تنش خشکی روی صفات بیوشیمیایی و ترکیبات اصلی اسانس نعناع فلفلی در استان تهران اجرا شد.
این آزمایش بهصورت کرتهای خردشده در قالب بلوکهای کامل تصادفی با سه تکرار در مزرعه دانشکده کشاورزی دانشگاه تربیت مدرس در بهار سال 1398 انجام شد. ارتفاع محل اجرای آزمایش از سطح دریا 1215 متر با طول جغرافیایی 51 درجه و هشت دقیقه شرقی و عرض جغرافیایی 35 درجه و 43 دقیقه شمالی می باشد. بر اساس آمار هواشناسی نزدیکترین ایستگاه هواشناسی(چیتگر) در دانشکده کشاورزی، این منطقه با 242 میلیمتر بارندگی سالانه دارای رژیم آب و هوایی نیمهخشک بوده و متوسط درجه حرارت سالیانه آن 22 درجه سانتیگراد است. نیاز آبی این گیاه حدود 4/664 میلی متر می باشد
(Ghamarnia & Mousabeygi, 2014).
تیمارهای آزمایشی شامل سه رژیم کم آبیاری (آبیاری تا حد ظرفیت مزرعه و بهترتیب بعد از تخلیه 25، 40 و 55 درصد آب قابل استفاده در منطقه ریشه؛ بهترتیب: بدون تنش، تنش متوسط و تنش شدید خشکی) به عنوان عامل اصلی، و هفت سطح محلولپاشی (اسیدهیومیک (یک، دو و سه درصد)، سرکه چوب (پنج، 10 و 15 درصد) و عدم محلولپاشی (شاهد)) به عنوان عامل فرعی بودند. محلولپاشی سرکه چوب و هیومیک اسید از مرحلۀ استقرار گیاه و هر 20 روز یکبار تا مرحله برداشت انجام شد. اعمال محلول پاشی ها در ساعت چهار بعد از ظهر و در هوای ملایم و بدون باد و هوای صاف انجام شد. به طوریکه برگ های گیاه نعناع کاملاً خیس شوند. گیاهان شاهد توسط آب مقطر محلول پاشی شدند. سرکه چوب از شرکت تعاونی فصل پنجم فرحبخش واقع در استان فارس – شهرستان داراب تهیه شد، اسیدهیومیک (شرکت تتاکو) از یکی از فروشگاه های فروش کود در کرج تهیه شد.
ریزوم های (به طور متوسط 15 سانتیمتر) نعناع فلفلی (توده محلی البرز) برای کشت از پژوهشکده گیاهان دارویی جهاد دانشگاهی تهیه و کاشت در تاریخ اول اردیبهشت 1398 صورت گرفت. هر کرت فرعی دارای شش ردیف کاشت به فاصله ردیف 20 سانتیمتر، فاصله بین هر بوته 20 سانتیمتر و به طول دو متر بود. علاوهبراین، بین هر کرت با کرت مجاور یک متر به صورت نکاشت در نظر گرفته شد. قبل از اجرای آزمایش از خاک مزرعه از عمق صفر تا ۳۰ سانتیمتری نمونهگیری و خصوصیات فیزیکی و شیمیایی آن اندازهگیری شد. محتوای نیتروژن و ماده آلی خاک به ترتیب 14/0 و 41/2 درصد، میزان فسفر و پتاسیم به ترتیب 6/27 و 320 میلی گرم در کیلوگرم و بافت خاک مزرعه از نوع لومی-شنی بود. با توجه به آزمایش خاک و غنی بودن خاک مزرعه از فسفر و پتاسیم، نیازی به کوددادن در زمان تهیه بستر نبود، مقدار کود نیتروژن به میزان 62 کیلوگرم در هکتار (از منبع اوره) اعمال شد.
آبیاری به صورت قطرهای و با استفاده از نوارهای آبیاری انجام شد. اولین آبیاری بلافاصله پس از کشت و آبیاریهای بعدی به صورت نرمال تا مرحله استقرار گیاهچه انجام شد. حجم آبیاری برای هر تیمار با کنتور کنترل شد. برای تعیین سطوح مختلف آبیاری از روابط ارائه شده توسط Behera & Panda (2009) استفاده شد. در این روش، برنامه زمانبندی آبیاری بر اساس درصد تخلیه آب خاک در منطقه ریشه و یا بیشینه تخلیه مجاز MAD (Maximum Allowable Depletion) بود. درصد MAD با رابطه 1 برآورد شد.
رابطه (1) 
FC رطوبت حجمی ظرفیت زراعی، رطوبت حجمی خاک و PWP رطوبت حجمی خاک در نقطه پژمردگی دائمی است. حجم آب مورد نیاز با رابطه های 2 و 3 محاسبه شد.

که در آن ASW (Available Soil Water) آب قابل دسترس خاک، V (Volume of irrigation water) حجم آب آبیاری (بر حسب میلیمتر)، Rz عمق موثر توسعه ریشه و 10 ثابت تبدیل سانتیمتر به میلی متر است. اعمال تنش خشکی بعد از مرحله استقرار بوتهها تا 20 درصد گلدهی در کرتهای مربوطه به وسیله دستگاه رطوبت سنج زمان (TDR) مدل TRIME-FM کشور انگلستان و محاسبه میزان پتانسیل آب خاک توسط منحنی رطوبتی خاک به وسیله دستگاه صفحه فشاری برای تیمارهای مختلف اعمال شد. قبل از شروع آزمایش از منحنیهای کالیبراسیون برای تعیین رابطه بین مقدار عددی قرائت شده توسط دستگاه TDR و مقدار حجمی رطوبت خاک استفاده شد (Heidarzadehet al., 2021). مبارزه با علفهای هرز بهصورت دستی انجام شد.
برای بررسی اثر تیمارهای آزمایشی، صفات ارتفاع بوته، وزن خشک کل، درصد و عملکرد اسانس، محتوای کلروفیل کل، فلاونوئیدها، فنل کل، ظرفیت آنتی اکسیدانی و ترکیبات اسانس (منتول، منتیلاستات، منتون و 1,8-cinole) اندازه گیری شدند. برداشت گیاه نعناع فلفلی برای اندازه گیری ارتفاع بوته، وزن خشک کل و اسانس در زمان مشاهده ده درصد گلدهی در 50 درصد از کرتها انجام شده و نمونههای گیاهی با حذف حاشیه از وسط هر کرت و از فاصله پنج سانتیمتری از کف زمین برداشت و پس از توزین به اتاق خشککن منتقل شدند. پس از خشک شدن نمونهها به صورت سایهخشک و در دمای اتاق 18 تا 22 درجه سانتیگراد، برای اندازهگیری وزن خشک کل 48 ساعت در آون قراد داده شد و با استفاده از ترازوی دقیق آزمایشگاهی (با دقت چهار صفر) وزن خشک کل محاسبه شد. از هرکرت به اندازه 50 گرم نمونه برگ سایه خشک با ترازو با دقت چهار صفر وزن و جدا شدند. اسانسگیری به روش تقطیر با آب مقطر با استفاده از دستگاه کلونجر به مدت سه ساعت بعد از به جوش آمدن انجام شد (Omid Beigi, 2009).
سنجش محتوی کلروفیل کل به روش آرنون (Arnon, 1967)، فلاونوئیدها به روش کریزیک (Krizek et al., 1993)، ظرفیت آنتی اکسیدانی به روش مهار DPPH و فنل کل به روش فولین- سینگلتون (Singleton & Rossi, 1965) انجام شد. اجزای اسانس با استفاده ازدستگاه کروماتوگرافی گازی متصل به طیفسنج جرمی (GC/MS)، با مشخصات مدل
Hewlett-Packard 6890 دارای انجکتور Splitless و ستون موئینه به طول 30 متر و قطر داخلی 25/0 میلیمتر و ضخامت فیلم 25 میلیمتر مدل DB-WAX (Agilent/J and W Scientific, Folsom, CA, USA) اندازهگیری شد.
دادههای حاصل از آزمایش با استفاده از نرمافزار SAS تجزیه شدند. مقایسه میانگین صفات به روش آزمون LSD در سطح احتمال پنج درصد انجام گرفت.
1-3. ارتفاع بوته و وزن خشک کل
جدول تجزیه واریانس نشان داد برهمکنش تنش خشکی و محلول پاشی تأثیر معنیداری روی ارتفاع بوته و وزن خشک نعناع فلفلی در سطح احتمال یک درصد داشت (جدول 1). مقایسه میانگین ها نشان داد تیمارهای دو درصد اسیدهیومیک، 10 و 15 درصد سرکه چوب به ترتیب با 48/37، 12/38 و 30/38 سانتیمتر در شرایط آبیاری مطلوب نسبت به سایر تیمارها، ارتفاع بوته بیشتری داشتند (جدول 2) و کمترین ارتفاع بوته 9/17 سانتیمتر در تنش خشکی شدید مشاهده شد (جدول 2).
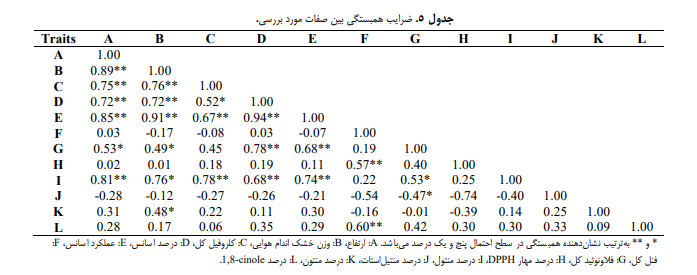
بیشترین وزن خشک کل (زیست توده) با محلولپاشی دو و سه درصد اسیدهیومیک در شرایط آبیاری مطلوب به ترتیب با 3204 و 3259 کیلوگرم در هکتار تولید شد (جدول 2) و کمترین مقدار آن در تیمار عدم محلولپاشی (شاهد) در شرایط تنش خشکی شدید با 1604 کیلوگرم در هکتار مشاهده شد (جدول 2). درحالیکه مقدار آن در غلظت های کاربرد پنج، 10 و 15 درصد سرکه چوب، به ترتیب 88/8، 88/28 و 02/43 درصد افزایش داشت (جدول 2). وزن خشک کل با ارتفاع همبستگی مثبت و معنی داری (**89/0r=) داشت (جدول 5)؛ به طوریکه با افزایش ارتفاع بوته، وزن خشک کل نیز افزایش یافت. اسیدهیومیک یکی از مهمترین ترکیبات شیمیایی موجود در خاک است که از تجزیه باکتریها و قارچها به دست میآید. این ترکیب باعث افزایش نقطه نموی رشد بوته و ارتفاع آن میشود. بررسیها نشان داده است که استفاده از اسیدهیومیک به طور میانگین باعث افزایش ارتفاع بوته حدود ۱۰ تا ۲۰ درصد در مقایسه با شاهد (بدون استفاده از اسیدهیومیک) میشود. همچنین، این ترکیب باعث رشد ریشهها و افزایش ظرفیت خاک برای نگهداری آب و عناصر غذایی میشود (Chen et al., 2004; Nardi et al., 2002). اولین دلیل اینکه اسیدهیومیک باعث افزایش ارتفاع بوته میشود، افزایش نقطه نموی رشد بوته است. بررسیها نشان داده است که اسیدهیومیک باعث افزایش طول سلولهای گیاه میشود و در نتیجه به افزایش ارتفاع بوته کمک میکند. این موضوع در تحقیقات مختلف نیز تأیید شده است. Jia et al.(2017) نشان دادند که کاربرد اسیدهیومیک باعث افزایش ارتفاع گیاهان ذرت شده و این افزایش به دلیل افزایش طول سلولهای گیاه بوده است. دلیل دومی که اسیدهیومیک باعث افزایش ارتفاع بوته میشود، بهبود رشد ریشههای گیاه است. اسیدهیومیک باعث رشد ریشههای گیاه میشود و در نتیجه باعث افزایش ارتفاع بوته میشود. بررسیهای انجام شده در این زمینه نشان داده است که اسیدهیومیک باعث افزایش تعداد ریشههای ثانویه در گیاهان مختلف میشود و این موضوع بهبود رشد ریشههای گیاه را تسهیل میکند (Nardi et al., 2002). محلولپاشی اسیدهیومیک باعث افزایش ارتفاع سیاهدانه (Azizi & Safaei, 2017) شد. افزایش جذب عناصر غذایی توسط گیاهان یکی از دلایل علمی افزایش وزن خشک بوته آنها پس از کاربرد اسیدهیومیک است. بررسیها نشان داده است که اسیدهیومیک میتواند باعث افزایش جذب عناصر غذایی از خاک توسط ریشههای گیاه شود (Nardi et al., 2002). این افزایش جذب عناصر غذایی، باعث تسهیل فرآیند فتوسنتز و افزایش تولید آنزیمهای مسئول در فعالیت متابولیکی گیاه میشود که در نتیجه باعث افزایش وزن خشک بوته گیاه میشود (Chen et al., 2004). استفاده از کود آلی اسیدهیومیک باعث جذب بهتر آب و انتقال مواد غذایی توسط گیاه شده و از این طریق باعث افزایش رشد ریشه و ساقه می شود (Moghbeli & Arvin, 2014) و به علت افزایش جذب سایر عناصر غذایی باعث افزایش رشد اندامهای هوایی میشود (Yuan et al., 2017). علاوهبر این، اسیدهیومیک باعث افزایش تولید هورمونهای گیاهی مانند اکسینها و جیبرلینها میشود که باعث رشد بوته و افزایش وزن خشک آن میشوند (García-Mina et al., 2004). از جمله دلایلی که میتواند باعث افزایش ارتفاع بوته و وزن خشک کل (زیست توده) گیاهان تحت تأثیر کاربرد سرکه چوب شود، میتوان به افزایش تولید و رشد سلولهای گیاهی اشاره کرد. بررسیها نشان داد که کاربرد سرکه چوب میتواند باعث افزایش تعداد سلولهای گیاهی و در نتیجه افزایش ارتفاع بوته شود. همچنین، کاربرد سرکه چوب میتواند باعث افزایش وزن خشک کل (زیست توده) گیاهان شود. به طور خاص، کاربرد سرکه چوب میتواند باعث افزایش تولید کلروفیل و فعالیت آنزیمهای مسئول در فرآیند فتوسنتز گیاه شود که در نتیجه باعث افزایش وزن خشک کل (زیست توده) گیاه میشود
(Sánchez-Moreiras et al., 2014). یکی از دلایل کاهش ارتفاع بوته و وزن خشک کل (زیست توده) گیاهان در اثر تنش کم آبی، کاهش فعالیت فتوسنتز و کاهش تولید کلروفیل است. تحت تنش کم آبی، گیاهان به دلیل کمبود آب، قادر به فتوسنتز بهینه نیستند و در نتیجه، تولید کلروفیل کاهش مییابد. این کاهش تولید کلروفیل، باعث کاهش فعالیت آنزیمهای مسئول در فرآیند فتوسنتز و در نتیجه، کاهش تولید آنزیمهای مسئول در فعالیت متابولیکی گیاه میشود که منجر به کاهش وزن خشک کل (زیست توده) گیاه میشود (Flexas et al., 2004). همچنین، تحت تنش کمآبی، عمق ریشههای گیاهان کاهش مییابد و رشد آنها محدود میشود. این موضوع باعث کاهش جذب آب و عناصر غذایی توسط گیاه میشود که در نتیجه، باعث کاهش ارتفاع بوته و وزن خشک کل (زیست توده) آن میشود (Chaves et al., 2003).

2-3. غلظت کلروفیل کل و فلاونوئید
غلظت کلروفیل کل و فلاونوئید تحت تأثیر برهمکنش تنش خشکی و محلولپاشی در سطح احتمال خطای یک درصد قرار گرفت (جدول 1). جدول مقایسه میانگین ها نشان داد بیشترین میزان کلروفیل کل در تیمارهای کاربرد دو و سه درصد اسیدهیومیک در شرایط آبیاری مطلوب به ترتیب با 185/3 و 206/3 میلیگرم در گرم وزن تر برگ و کاربرد سه درصد اسیدهیومیک در شرایط تنش خشکی متوسط با 249/3 میلی گرم در گرم وزن تر برگ مشاهده شد (جدول 2). ولی تیمارهای کاربرد 10 و 15 درصد سرکه چوب در شرایط تنش خشکی متوسط (به ترتیب 338/0 و 337/0 میکرومول در گرم وزن تر برگ) نسبت به سایر تیمارها، فلاونوئید بالاتری داشتند (جدول 2). کلروفیل کل با ارتفاع بوته (**75/0r=) و وزن خشک کل (**76/0r=) همبستگی مثبت و معنی داری نشان داد (جدول 5). همچنین، فلاونوئید با ارتفاع (*53/0r=) و وزن خشک کل (*49/0r=) همبستگی مثبت و معنی داری داشت (جدول 5). یکی از دلایل افزایش محتوای کلروفیل در گیاهان با کاربرد اسیدهیومیک، افزایش فعالیت آنزیمهای مسئول در فرآیند ساخت کلروفیل است. تحت تأثیر اسیدهیومیک، فعالیت آنزیمهای مسئول در فرآیند ساخت کلروفیل افزایش مییابد که در نتیجه، تولید کلروفیل نیز افزایش مییابد. همچنین، اسیدهیومیک میتواند باعث افزایش جذب نور توسط برگها و افزایش میزان فتوسنتز گیاه شود که در نتیجه، تولید کلروفیل نیز افزایش مییابد (Canellas et al., 2002). کاربرد اسیدهیومیک در گیاهان برنج مورد بررسی قرار گرفت و نتایج نشان داد که کاربرد اسیدهیومیک باعث افزایش محتوای کلروفیل در برگها و بهبود عملکرد فتوسنتزی گیاهان برنج میشود (Ahmad et al., 2012). اسیدهیومیک با قرار دادن آب و مواد غذایی بیشتر و مناسبتر در اختیار گیاه، میزان ساخت رنگیزه ها را افزایش داده و انتقال مواد فتوسنتزی را بهصورت راحت تری در اختیار گیاه قرار میدهد
(Davoodifard et al., 2012). فلاونوئیدها یک گروه از ترکیبات فنلی هستند که در برگها و سایر اندامهای گیاهی تولید میشوند و نقش مهمی در مقاومت گیاهان به تنشهای مختلف دارند. Tian et al.(2016) گزارش کردند کاربرد اسیدهیومیک در گیاهان سیر مورد بررسی قرار گرفت و نتایج نشان داد که کاربرد اسیدهیومیک باعث افزایش تولید فلاونوئیدها در سیر میشود
(Tian et al., 2016). سرکه چوب حاوی اسید است که میتواند فعالیت آنزیمهای مسئول در فرآیند ساخت فلاونوئید را افزایش دهد و در نتیجه، تولید فلاونوئید نیز افزایش مییابد (Ghasemzadeh et al., 2010). کاربرد سرکه چوب در گیاهان آلوئهورا نشان داد که کاربرد سرکه چوب باعث افزایش تولید فلاونوئید در آلوئه ورا میشود (Khorasaninejad et al., 2019).
3-3. درصد و عملکرد اسانس
جدول تجزیه واریانس نشان داد درصد و عملکرد اسانس نعناع فلفلی تحت تأثیر برهمکنش تنش خشکی و محلولپاشی در سطح احتمال یک درصد قرار گرفت (جدول 1). بیشترین محتوی اسانس در تیمار 15 درصد سرکه چوب در شرایط تنش خشکی متوسط (183/1 درصد) تولید شد و با تیمار 10 درصد سرکه چوب در شرایط تنش خشکی متوسط (155/1 درصد)، تیمار 10 درصد سرکه چوب (156/1 درصد)، 15 درصد سرکه چوب (147/1 درصد) و سه درصد اسیدهیومیک (149/1 درصد) در شرایط آبیاری مطلوب در یک گروه آماری قرار گرفت (جدول 2). جدول همبستگی نشان داد درصد اسانس با ارتفاع بوته (**72/0r=)، وزن خشک کل (**72/0r=)، کلروفیل کل (*52/0r=) و فلاونوئید (**78/0r=) همبستگی مثبت و معنیداری دارد (جدول 5). عملکرد اسانس با ارتفاع بوته (**85/0r=)، وزن خشک کل (**91/0r=)، کلروفیل کل (**67/0r=)، فلاونوئید (**68/0r=) و درصد اسانس (**94/0r=) همبستگی مثبت و معنیداری داشت (جدول 5). لذا با توجه به نتایج همبستگی صفات مشخص شد که وزن خشک کل و درصد اسانس روی عملکرد اسانس تأثیر دارند و در این پژوهش با توجه به ضرایب همبستگی، میزان تأثیر درصد اسانس بیشتر از وزن خشک کل بود (جدول 5).

یکی از دلایل افزایش درصد و عملکرد اسانس با کاربرد اسیدهیومیک، افزایش فعالیت آنزیمهای مسئول در فرآیند ساخت اسانس در گیاهان است. اسیدهیومیک میتواند با افزایش فعالیت آنزیمهای مسئول در فرآیند ساخت اسانس، تولید اسانس را افزایش دهد (Khalid et al., 2018). اسیدهیومیک از طریق فراهم کردن جذب بیشتر فسفر و نیتروژن که در اجزای تشکیل دهنده اسانس حضور دارند، موجب افزایش میزان اسانس پیکر رویشی گیاه میشود
(Niakan & Khavarinezhad, 2003). در یک تحقیق، کاربرد اسیدهیومیک در گیاهان ریحان مورد بررسی قرار گرفت و نتایج نشان داد که کاربرد اسیدهیومیک باعث افزایش درصد و عملکرد اسانس در ریحان میشود (Rouhiet al., 2018). همچنین، در یک تحقیق دیگر، استفاده از کودهای حاوی اسیدهیومیک باعث افزایش درصد و عملکرد اسانس در گیاهان نعناع و یونجه شده است (Gomaa et al., 2017). به طور کلی، افزایش فعالیت آنزیمهای مسئول در فرآیند ساخت اسانس و افزایش جذب عناصر غذایی توسط گیاهان به عنوان دو دلیل اصلی افزایش درصد و عملکرد اسانس با کاربرد اسیدهیومیک مطرح شدهاند. در یک تحقیق، کاربرد سرکه چوب در گیاهان نعناع و ریحان مورد بررسی قرار گرفت و نتایج نشان داد که کاربرد سرکه چوب باعث افزایش درصد و عملکرد اسانس در این گیاهان میشود. همچنین، در این تحقیق مشاهده شد که کاربرد سرکه چوب باعث افزایش محتوای کلروفیل در نعناع و ریحان نیز میشود (Mohamed & El-Maghraby, 2016). کاهش عملکرد اسانس در شرایط تنش کمآبی در گیاهان ریحان مورد بررسی قرار گرفت و نتایج نشان داد که در شرایط تنش کمآبی، عملکرد اسانس در گیاه ریحان کاهش مییابد. همچنین، در این تحقیق مشاهده شد که تنش کمآبی باعث افزایش محتوای اسانس در گیاه ریحان میشود، دلیل افزایش درصد اسانس در شرایط تنش، محافظت گیاه در برابر شرایط تنش میباشد (Ramoliya et al., 2018).
4-3. فنل کل و ظرفیت آنتی اکسیدانی
بررسی جدول تجزیه واریانس نشان داد برهمکنش تنش خشکی و محلولپاشی تأثیر معنی داری در سطح احتمال یک درصد روی فنل کل و ظرفیت آنتی اکسیدانی گذاشت (جدول 3). جدول مقایسه میانگین ها نشان داد بیشترین میزان فنل کل در تیمار کاربرد سه درصد اسیدهیومیک در شرایط تنش خشکی شدید با 28/19 میلی گرم اسیدگالیک در گرم وزن تر برگ تولید شد (جدول 4) و کمترین مقدار آن در تیمارکاربرد یک درصد اسیدهیومیک در شرایط آبیاری مطلوب مشاهده شد (جدول 4). همچنین، تیمار کاربرد سه درصد اسیدهیومیک در شرایط تنش خشکی شدید، بیشترین مهار DPPH(2,2-Diphenyl-1-picrylhydrazyl) را داشت که با تیمارهای کاربرد 15 درصد سرکه چوب در شرایط تنش کم آبی شدید و کاربرد سه درصد اسیدهیومیک و 15 درصد سرکه چوب در شرایط تنش کم آبی متوسط در یک گروه آماری قرار گرفت (جدول 4). بیشترین مقدار فنل کل از کاربرد 10 درصد سرکه چوب در شرایط تنش کم آبی شدید به دست آمد (جدول 4). فنل کل با ظرفیت آنتی اکسیدانی (**57/0r=) همبستگی مثبت و معنیداری داشت (جدول 5)، ولی با سایر صفات همبستگی معنی داری نشان نداد (جدول 5). لذا با افزایش فنل کل، ظرفیت آنتی اکسیدانی نیز افزایش یافت. فنل کل یکی از ترکیبات فعال گیاهی است که در شرایط تنش خشکی میتواند به عنوان یک عامل محافظت از گیاه عمل کند. فنل کل با داشتن خاصیت آنتیاکسیدانی، میتواند در محافظت از سلولهای گیاهی در شرایط تنش خشکی نقش داشته باشد. همچنین، فنل کل باعث افزایش فعالیت آنزیمهای مسئول در فرآیند ساخت اسانس میشود که در نتیجه تولید اسانس در شرایط تنش خشکی افزایش مییابد (Bose et al., 2014).
در یک تحقیق، تأثیر فنل کل در شرایط تنش خشکی در گیاه ریحان مورد بررسی قرار گرفت و نتایج نشان داد که کاربرد فنل کل باعث کاهش تأثیرات منفی تنش خشکی روی رشد و عملکرد گیاه ریحان میشود. همچنین، در این تحقیق مشاهده شد که کاربرد فنل کل باعث افزایش عملکرد اسانس و محتوای فنلی در گیاه ریحان در شرایط تنش خشکی میشود
(Sharma et al., 2019). در یک تحقیق، تأثیر تنش خشکی بر فعالیت آنتیاکسیدانی و محتوای فنلی در گیاه کینوا مورد بررسی قرار گرفت. همچنین، این تحقیق نشان داد که استفاده از کودهای آلی و برخی ترکیبات آلی مانند اسیدهیومیک، باعث افزایش فعالیت آنتیاکسیدانی و محتوای فنلی در گیاه کینوا در شرایط تنش خشکی میشود (Zhu et al., 2021).
5-3. ترکیبات اصلی اسانس
ترکیبات اصلی اسانس (منتول، منتیلاستات، منتون و 1,8-cinole) تحت تأثیر برهمکنش تنش خشکی و محلولپاشی در سطح احتمال یک درصد قرار گرفتند (جدول 3). جدول مقایسه میانگینها نشان داد بیشترین مقدار منتول از کاربرد 10 درصد سرکه چوب در شرایط آبیاری مطلوب با 04/61 درصد به دست آمد (جدول 4) و با تیمار کاربرد دو درصد اسیدهیومیک در شرایط تنش خشکی متوسط با 15/60 درصد در یک گروه آماری قرار گرفت (جدول 4). نتایج نشان داد مقدار منتول با کاربرد اسیدهیومیک و سرکه چوب، نسبت به عدم استفاده از آن ها در شرایط تنش خشکی متوسط و شرایط آبیاری مطلوب به ترتیب 19/42 و 3/44 درصد افزایش یافت (جدول 4). منتیل استات در تیمار شاهد در شرایط آبیاری مطلوب (79/24 درصد) بیشتر از سایر تیمارها شد (جدول 4). همچنین، بیشترین میزان منتون نیز در تیمار شاهد در شرایط آبیاری مطلوب با 95/2 درصد بیشتر از سایر تیمارها بود و با کاربرد سه درصد اسیدهیومیک در شرایط آبیاری مطلوب در یک گروه آماری قرار گرفت (جدول 4)؛ درحالیکه بیشترین مقدار 1,8-cinole در تیمار محلولپاشی 10 درصد سرکه چوب در شرایط تنش خشکی شدید با 91/3 درصد مشاهده شد (جدول 4).


میانگین های دارای حداقل یک حرف مشترک در هر ستون فاقد اختلاف معنی دار براساس آزمون LSD میباشند.بعد از علامت ± خطای استاندارد قرار دارد. (H-1%: محلولپاشی یک درصد اسیدهیومیک، H-2%: محلولپاشی دو درصد اسیدهیومیک، H-3%: محلولپاشی سه درصد اسیدهیومیک، WV-5%: محلولپاشی سرکه چوب پنج درصد، WV-10%: محلولپاشی سرکه چوب 10 درصد، WV-15%: محلولپاشی سرکه چوب 15 درصد و Control: شاهد (بدون محلولپاشی)).
اسیدهیومیک یک ترکیب آلی است که در کودهای آلی استفاده میشود و میتواند روی پروفایل اسانس گیاهان تأثیر بگذارد. تحقیقات Hassani et al. (2018) نشان داده است که استفاده از اسیدهیومیک میتواند باعث افزایش محتوای اسانس و تغییر در پروفایل ترکیبات شیمیایی آن شود. در یک تحقیق، تأثیر اسیدهیومیک بر پروفایل اسانس گیاه آویشن (Thymus vulgaris L.) مورد بررسی قرار گرفت. نتایج این تحقیق نشان داد که استفاده از اسیدهیومیک، باعث افزایش محتوای اسانس و تغییر در پروفایل ترکیبات شیمیایی آن شده است. در این تحقیق، محتوای کارواکرول در گروهی که با اسیدهیومیک تیمار شده بودند، بیشتر از گروه شاهد بود. همچنین، میزان ترپنوئیدها و فنلها در گروهی که با اسیدهیومیک تیمار شده بودند، بیشتر از گروه شاهد بودند (Hassaniet al., 2018). بنابراین، میتوان نتیجه گرفت که استفاده از اسیدهیومیک میتواند بر پروفایل اسانس گیاهان تأثیر بگذارد و باعث افزایش محتوای اسانس و تغییر در ترکیبات شیمیایی آن شود. در یک تحقیق دیگر، تأثیر اسیدهیومیک بر پروفایل اسانس گیاهان نعنا فلفلی و نعناع دشتی (Mentha spicata L.) مورد بررسی قرار گرفت. نتایج این تحقیق نشان داد که استفاده از اسیدهیومیک، باعث افزایش محتوای اسانس و تغییر در پروفایل ترکیبات شیمیایی آنها شده است. در این تحقیق، استفاده از اسیدهیومیک باعث افزایش محتوای اسانس در گیاه نعناع دشتی شده است. همچنین، ترکیبات اصلی اسانس نعناع فلفلی شامل منتول، منتون و کاروفیلنها در گروهی که با اسیدهیومیک تیمار شده بودند، بیشتر از گروه کنترل بودند. در مورد گیاه نعناع دشتی، میزان محتوای اسانس و ترکیبات اسانس در گروهی که با اسیدهیومیک تیمار شده بود، بیشتر از گروه کنترل بودند، اما این تفاوت در مقادیر به دلیل تفاوتهای محیطی و ژنتیکی در این دو گیاه بود (Javanmardi et al., 2014). جدول همبستگی نشان داد درصد منتول با ارتفاع (**81/0r=)، وزن خشک کل (**76/0r=)، کلروفیل کل (**78/0r=)، درصد اسانس (**68/0r=)، عملکرد اسانس (**74/0r=) و فلاونوئید (*53/0r=) همبستگی مثبت و معنیداری دارد (جدول 5). درحالیکه درصد متیلاستات با فلاونوئید (*47/0-r=) همبستگی منفی و معنی داری نشان داد (جدول 5). همچنین، درصد منتول با وزن خشک کل (*48/0r=) و درصد 1,8-cinole با فنل کل (**60/0r=) همبستگی مثبت و معنی داری دارد (جدول 5). همبستگی مثبت از نظر فیزیولوژیکی نشاندهنده تغییرات مثبت (افزایش) یک صفت در بالابردن مقدار صفت دیگر می باشد. لذا با افزایش وزن خشک کل و فنل کل، محتوی منتول نیز افزایش داشت.
نتایج این پژوهش نشان داد که محلولپاشی اسیدهیومیک و سرکه چوب باعث افزایش خصوصیات کیفی و کمی گیاه نعناع فلفلی شد؛ به طوریکه کاربرد اسیدهیومیک و سرکه چوب در غلظت های مختلف باعث افزایش ارتفاع بوته، وزن خشک کل، کلروفیل کل و فلاونوئید شد. تنش خشکی تأثیر منفی روی عملکرد اسانس داشت. نتایج نشان داد کاربرد سرکه چوب و اسیدهیومیک باعث افزایش کیفیت اسانس نعناع فلفلی شد؛ به طوریکه بیشترین مقدار منتول از کاربرد 10 درصد سرکه چوب در شرایط آبیاری مطلوب با 04/61 درصد بهدست آمد و با تیمار کاربرد دو درصد اسیدهیومیک در شرایط تنش خشکی متوسط با 15/60 درصد در یک گروه آماری قرار گرفت. با توجه به محدویت آب و نتایج این پژوهش، استفاد از محلولپاشی سه درصد اسیدهیومیک شرایط آبیاری مطلوب و تنش خشکی متوسط و کاربرد 15 درصد سرکه چوب در شرایط تنش خشکی شدید به دلیل افزایش کیفیت اسانس و عملکرد اسانس در استان تهران و مناطق مشابه پیشنهاد می شود.
Adel, M., Abedian Amiri, A., Zorriehzahra, J., Nematolahi, A., & Esteban, M.A. (2015). Effects of dietary peppermint (Mentha piperita L.) on growth performance, chemical body composition and hematological and immune parameters of fry Caspian white fish (Rutilus frisiikutum). Fish Shellfish Immunology, 45(2), 841-847.
Ahmad, M., Zahir, Z.A., Asghar, H.N., Asghar, M., & Arshad, M. (2020). Humic acid application improves maize (Zea mays L.) performance under water stress. Journal of Plant Nutrition, 43(9), 1280-1290.
Ahmad, R., Waraich, E.A., Nawaz, F., Ahmad, I., & Ahmad, M.S.A. (2012). Effect of humic acid on the growth, yield, and nutrient content of rice (Oryza sativa L.). Journal of Plant Nutrition, 35(2), 202-215.
Ahmed, O.H., El-Bassiouny, H.M.S., & El-Hadidy, M.E. (2019). Effect of wood vinegar on the growth and yield of maize under different irrigation intervals. Journal of Agricultural Science and Technology, 9(3), 275-285.
Anjum, S.A., Xie, X.Y., Wang, L.C., Saleem, M.F., Man, C., & Lei, W. (2011). Morphological, physiological and biochemical responses of plants to drought stress. African Journal of Agricultural Research, 6(9), 2026-2032.
Arnon, D.I. (1949). Copper enzymes in isolated chloroplasts. Polyphennoloxidase in Beta vulgaris. Plant Physiology, 24, 1-150.
Azizi, M., & Safaei, Z. (2017). Effect of using humic acid and formaxnano fertilizer on morphological traits, yield, essential content and (Nigella sativa L.). Journal of Horticultural Sciences, 30(4), 671-680.
Bacon, M. (2004). Water use efficiency in plant biology. In water use efficiency in plant biology, (Ed Bacon M), Black well Publishing. 344 pp.
Behera S.K., & Panda, R.K. (2009). Effect of fertilization and irrigation schedule on water and fertilizer solute transport for wheat crop in a sub-humid sub-tropical region. Agriculture, Ecosystems and Environment, 130, 141-155.
Bose, S., Tripathi, A.K., Yadav, S., & Yadav, S.K. (2014). Influence of drought stress on growth, yield and physiological parameters of medicinal plants: A review. Journal of Medicinal Plants Research, 8(21), 731-764.
Canellas, L.P., Olivares, F.L., & Okorokova-Façanha, A.L. (2002). Humic acids isolated from earthworm compost enhance root elongation, lateral root emergence, and plasma membrane H+-ATPase activity in maize roots. Plant and Soil, 246(2), 185-196.
Canellas, L.P., Olivares, F.L., Aguiar, N.O., Jones, D.L., Nebbioso, A., Mazzei, P., & Piccolo, A. (2002). Humic and fulvic acids as biostimulants in horticulture. Scientia Horticulturae, 103(1), 1-25.
Canellas, L.P., Olivares, F.L., Okorokova-Façanha, A.L., & Façanha, A.R. (2015). Humic acids isolated from earthworm compost enhance root elongation, lateral root emergence, and plasma membrane H+-ATPase activity in maize roots. Plant and Soil, 395(1-2), 337-349.
Chaves, M.M., Maroco, J.P., & Pereira, J.S. (2003). Understanding plant responses to drought - from genes to the whole plant. Functional Plant Biology, 30(3), 239-264.
Chaves, M.M., Pereira, J.S., Maroco, J.P., Rodrigues, M.L., Picardo, C.P.P., Osorio, M.L., Carvalho, I., Faria, T., & Pinheiro, C. (2002). How plants cope with water stress in the field. Photosynthesis and growth. Annals of Botany, 89, 907–916.
Chen, Y., Clapp, C.E., Magen, H., & Bloom, P.R. (2019). Humic and fulvic acids and their potential in crop production and environmental management. Advances in Agronomy, 154, 189-238.
Chen, Y., Clapp, C.E., Magen, H., & Mikkelsen, R.L. (2004). The nature of soil organic matter affects phosphorus release from soil. Soil Science Society of America Journal, 68(6), 2048-2054.
Court, W.A., Roy, R.C., & Pocs, R. (1993). Effect of harvest date on the yield and quality of the essential oil of peppermint. Canadian Journal Plant Science, 73, 815–824.
Davoodifard, M., Habibi, D., & Davoodifard, F. (2012). Effects of salinity stress on membrane stability, chlorophyll content and yield components of wheat inoculated with plant growth promoting bacteria and humic acid. Iranian Journal of Agronomy and Plant Breeding, 2(8), 76-81. (In Persian).
Flexas, J., Bota, J., Escalona, J.M., Sampol, B., & Medrano, H. (2004). Effects of drought on photosynthesis in grapevines under field conditions: An evaluation of stomatal and mesophyll limitations. Functional Plant Biology, 31(2), 123-131.
Food and Agriculture Organization (FAO). (2020). The State of Food and Agriculture 2020. Overcoming water challenges in agriculture. FAO: Rome. Retrieved from: http://www.fao.org/3/ca9692en/ca9692en.pdf.
García-Mina, J.M., Antolín, M.C., & Sánchez-Díaz, M. (2004). Metal complexation by humic substances and their structural features. Journal of Geochemical Exploration, 82(1), 117-124.
Ghamarnia, H., &Mousabeygi, F. (2014). Determination of Mentha pipertia (L.) water requirement, single and dual crop coefficients. Journal of Water and Soil, 28(4), 670-678.
Ghasemzadeh, A., Jaafar, H.Z.E., & Rahmat, A. (2010). Effects of solvent type on phenolics and flavonoids content and antioxidant activities in two varieties of young ginger (Zingiber officinale Roscoe) extracts. Journal of Medicinal Plants Research, 4(24), 2674-2681.
Gomaa, E.Z., El-Gizawy, A.M., Mohamed, H.I., & Abd El-Mawla, A.A. (2017). Effect of foliar application with humic acid and zinc on growth, yield and essential oil of peppermint and alfalfa. Journal of Applied Sciences Research, 3(12), 25-34.
Hassani, A., Azizi, M., & Ghorbanpour, M. (2018). Effect of humic acid on essential oil content and composition of Thymus vulgaris (L.) under drought stress. Journal of Essential Oil Bearing Plants, 21(3), 675-684.
Heidarzadeh, A., Modarres-Sanavy, S.A.M., & Mokhtassi-Bidgoli, A. (2020). Effect of nitrogen on some quantitative and qualitative traits of Dracocephalum kotschyi Boiss. Iranian Journal of Horticultural Science, 51(3), 705-717. (In Persian).
Heidarzadeh, A., Modarres-Sanavy, S.A.M., & Mokhtassi-Bidgoli, A. (2021) Changes in yield and essential oil compositions of Dracocephalum kotschyi Boiss in response to azocompost, vermicompost, nitroxin, and urea under water deficit stress. Journal of Soil Science and Plant Nutrition, 22, 896-913.
Javanmardi, J., Khalighi, A., Kashi, A., & Bais, H.P. (2014). Effect of salinity stress on yield, component of essential oil and physiological parameters of two species of mint (Mentha × piperita and Mentha spicata). Industrial Crops and Products, 53, 252-259.
Jia, Y., Li, Y., Liu, Z., & Li, C. (2017). Humic acid promotes maize (Zea mays L.) root elongation by regulating endogenous hydrogen peroxide. Plant Growth Regulation, 83(3), 427-436.
Kamatou, G.P.P., Vermaak, I., Viljoen, A.M., & Lawrence, B.M. (2013). Menthol: A simple monoterpene with remarkable biological properties. Phytochemical, 96, 15–25.
Khalid, R., Aslam, R., Khan, M.Y., Shahid, M.A., & Ahmed, I. (2018). Effect of humic acid on growth, yield and quality of tomato grown under greenhouse conditions. Journal of Soil Science and Plant Nutrition, 18(1), 89-101.
Khan, W., Mobin, M., Abbas, Z.K., & Alawlaqi, M.M. (2019). Wood vinegar: A potential tool to mitigate drought stress in plants. Plants, 8(12), 595.
Khorasaninejad, S., Gohari, G., Mousavi, S.R., Asghari, H.R., Ramroudi, M., & Karimi, N. (2019). The effect of wood vinegar on growth and secondary metabolites of Aloe vera (L.). Industrial Crops and Products, 138, 111480.
Krizek, D.T., Kramer, G.F., Upadhyaya, A., & Mirecki, R.M. (1993). UV-B Response of cucumber seedling grown under metal halid and high-pressure sodium/deluxe lamps. Physiology of Plant, 88, 350-358.
McKay, D.L. & Blumberg, J.B. (2006). A review of the bioactivity and potential health benefits of peppermint tea (Mentha piperita L.). Phytotherapy Research, 20, 619-633.
Moghbeli, T., & Arvin, M.J. (2014). Effect of seed preparation with application of growth regulators on germination, growth and yield melon fruit. Journal Production and Processing of Agricultural and Horticultural Products, 4(14), 23-33.
Mohamed, H.A., & El-Maghraby, A.A. (2016). Effect of wood vinegar on growth, yield and quality of sweet basil and peppermint. Journal of Applied Sciences Research, 2(12), 13-20.
Mucciarelli, M., Camusso, W., Bertea, C.M., Bossi, S., & Maffei, M. (2001). Effect of (+)-pulegon and other oil components of Mentha piperita on cucumber respiration. Phytochemical, 57, 91-8.
Munne-Bosh, S., Jubany-Mari, T., & Alegre, L. (2001). Drought-induced senescence is characterized by a loss of antioxidant defenses in chloroplasts. Plant, Cell and Environment, 24, 1319-1327.
Munns, R. (2002). Comparative physiology of salt and water stress. Plant, Cell & Environment, 25(2), 239-250.
Nardi, S., Pizzeghello, D., Muscolo, A., & Vianello, A. (2002). Physiological effects of humic substances on higher plants. Soil Biology and Biochemistry, 34(11), 1527-1536.
Niakan, M., Khavarnezhad, R.A., & Rezai, M.B. (2003). The effect of different amounts of fertilizer NPK on fresh and dry weight, leaf and oil content of Mentha piperitae (L.). Journal of Medicinal and Aromatic Plant Research of Iran, 20, 131-148. (In Persian).
Omid Baigi, R. (2009). Production and processing of medicinal plants (Vol. 2). Astan Quds Razavi. 438p. (In Persian).
Ramoliya, P.J., Patel, P.G., & Patel, H.H. (2018). Effect of drought stress on growth, yield and quality of essential oil of sweet basil (Ocimum basilicum L.). International Journal of Chemical Studies, 6(1), 149-152.
Rios-Estepa, R., Turner, G.W., Lee, J.M., Croteau, R.B., & Lange, B.M. (2008). A systems biology approach identifies the biochemical mechanisms regulating monoterpenoid essential oil composition in peppermint. PNAS. 105(8), 2818-2823.
Rouhi, H.R., Khoshgoftarmanesh, A.H., Shariatmadari, H., & Schulin, R. (2018). Humic acid promotes essential oil production of basil (Ocimum basilicum L.) by inducing the expression of genes involved in methanolic and shikimic acid pathways. Industrial Crops and Products, 112, 37-45.
Sánchez-Moreiras, A.M., López, M.G., Miguel, M.G., Cámara, M., González, L., Escandón, A., Rambla, J.L., & Fernández, J.A. (2014). Vinegar residues as an alternative to herbicides: A study of their potential use as a natural mulching agent. Journal of Agricultural and Food Chemistry, 62(8), 1865-1874.
SeifSahandi, M., Naghdi Badi, H., Mehrafarin, A., Khalighi-Sigaroodi, F., & Sharifi, M. (2019). Changes in essential oil content and composition of peppermint (Mentha piperita L.) in responses to nitrogen application. Journal of Medicinal Plants, 18(4), 81-98. (In Persian).
Sharma, P., Yadav, M.R., & Sardana, V. (2019). Exogenous application of phenolic compounds improves growth, yield, and secondary metabolite content of Ocimum basilicum (L.) under water deficit stress. Physiology and Molecular Biology of Plants, 25(2), 457-468.
Singleton, V.L., & Rossi, J.A. (1965). Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture, 16(3), 144-158.
Taiz, L., & Zeiger, E. (2002). Plant Physiology. 3rd edition, Sinauer Associates, Sunderland. 690 pp.
Tian, S., Lu, L., Labavitch, J.M., & Yang, X. (2016). Effect of humic acids on plant growth and nutrient uptake of wheat (Triticum aestivum L.) grown in two different soils. Journal of Plant Nutrition and Soil Science, 179(3), 406-411.
Uddin, M.K., Juraimi, A.S., Ismail, M.R., Hossain, M.S., & Othman, R. (2014). Effect of wood vinegar on weed suppression, growth, yield and quality of tomato (Solanum lycopersicum). PLoS One, 9(7), e101857.
Yuan, T., Wang, J., Sun, X., Yan, J., Wang, Z., & Niu, J. (2017). Effect of combined application of humic acid and nitrogen fertilizer on nitrogen uptake, utilization and yield of winter wheat. Chinese Journal of Eco-Agriculture, 3, 74-82.
Zhang, J., & Yang, J. (2004). Crop yield and water use efficiency a case study in rice. M.A, Bacon (ed.) Water use efficiency in Plant Biology, Blackwell Publishing. 344 pp.
Zhu, Y., Wu, Y., Cheng, Y., Liu, Y., Li, Y., & Li, H. (2021). Effects of organic fertilizers on antioxidant activity and phenolic content of quinoa (Chenopodium quinoa Willd.) under drought stress. Journal of Soil Science and Plant Nutrition, 21(1), 197-206.